
Pruebas sindromáticas en pacientes hospitalizados con infección respiratoria grave
Dra. Malefu Moleleki
División de Microbiología de la Universidad Stellenbosch Ciudad del Cabo, Sudáfrica.
La dificultad para obtener un rápido diagnóstico etiológico (virus-bacterias-hongos) de las infecciones respiratorias resulta en un dilema al momento de iniciar, limitar o escalar un tratamiento antibiótico. La resistencia antibiótica es un desafío que puede enfrentarse por medio de la utilización de técnicas sindromáticas moleculares que permiten un rápido diagnóstico1, aún en pacientes con tratamiento antibiótico.
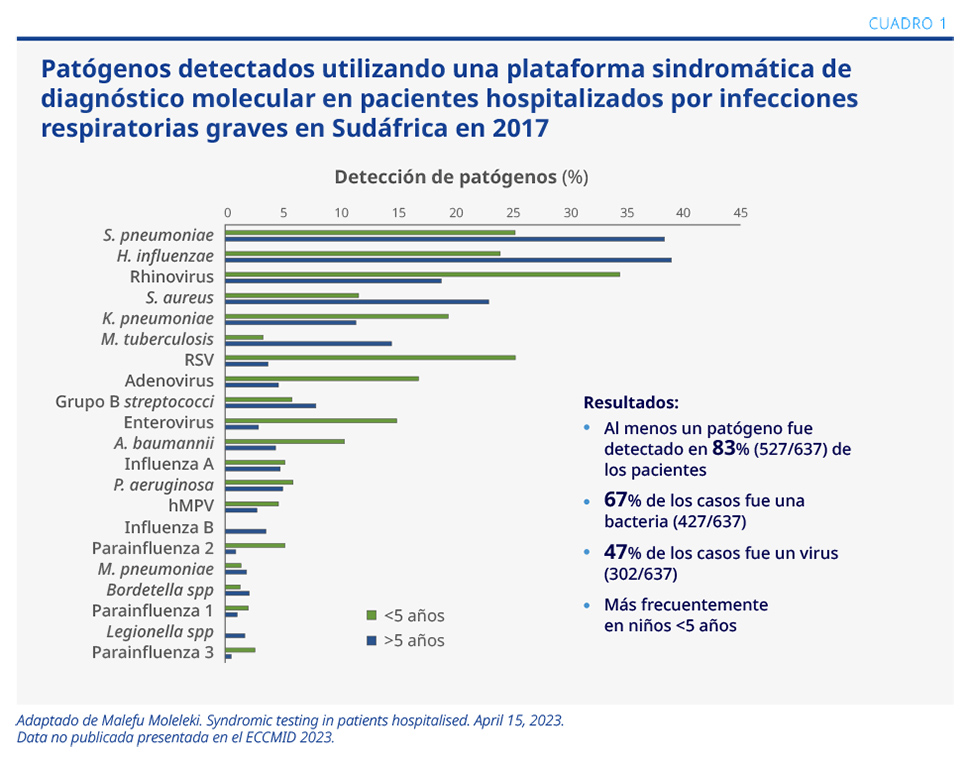
Durante el año 2017, un estudio multicéntrico en Sudáfrica utilizó una prueba sindromática para múltiples patógenos (21 en total) en 637 pacientes hospitalizados por infecciones respiratorias graves.1 Los resultados mostraron que, al menos, en el 83% de los casos fue detectado un patógeno, en su mayoría bacterias (67%) vs. virus (47%), (ver Cuadro 1). En niños las causas virales fueron mayores a lo reportado en adultos.
Uno de los desafíos al momento de la interpretación de los datos es la presencia de coinfecciones, siendo evidentes hasta en un 57% en el estudio sudafricano. La comparación con hemocultivos mostró que la tasa de detección de patógenos fue superior en pruebas sindromáticas moleculares vs. sanguíneas, 87% vs. 48%, respectivamente.
Conclusiones
• Los algoritmos de manejo deben contemplar qué grupo de pacientes puede beneficiarse con el uso de estas técnicas.2
• Estas pruebas requieren de personal entrenado, por lo que debe definirse si son aplicables en centros de atención primaria vs. terciaria.
• Los departamentos de emergencias deben utilizar estas técnicas, ya que se ha demostrado una reducción de la estadía en el hospital y un menor número de días con tratamiento antibiótico.3
Referencias
1. Moleleki M, et al. Pathogens detected using a syndromic molecular diagnostic platform in patients hospitalized with severe respiratory illness in South Africa in 2017. Int J Infect Dis. 2022 Sep;122:389-397.
2. Dumkow LE, et al. Syndromic diagnostic testing: a new way to approach patient care in the treatment of infectious diseases. J Antimicrob Chemother. 2021 Sep 23;76(Suppl 3):iii4-iii11.
3. Rappo U, et al. Impact of Early Detection of Respiratory Viruses by Multiplex PCR Assay on Clinical Outcomes in Adult Patients. J Clin Microbiol. 2016 Aug;54(8):2096-103.
¿Fueron utilizados adecuadamente los antimicrobianos durante la pandemia por COVID-19?
Dra. Refath Farzana
Universidad de Oxford, Departamento de Biología Reino Unido.
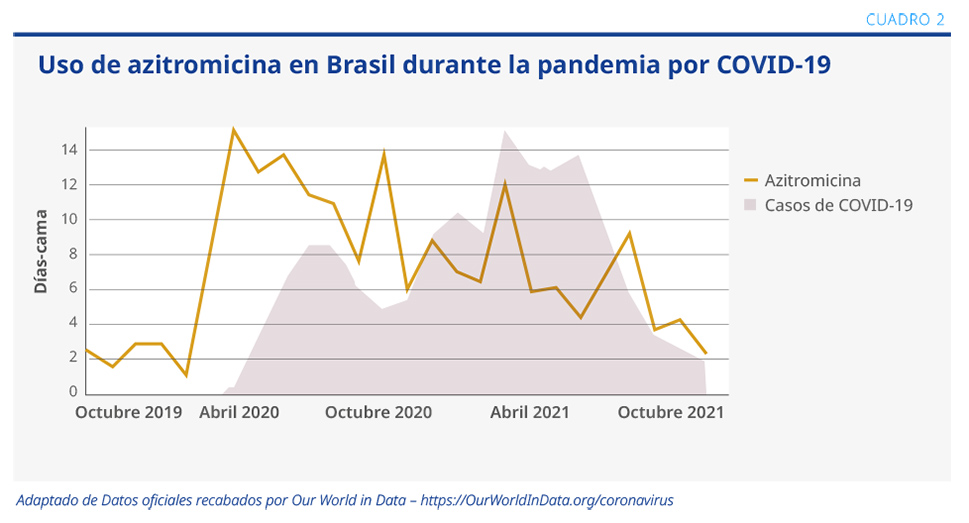
Para contestar esta pregunta, se realizó un estudio observacional entre los meses de octubre del 2019 y noviembre del 2021, en el que se evaluaron datos de pacientes internados en distintos países. Se observó que, comparado con el período prepandemia, el uso de agentes antimicrobianos se incrementó durante la pandemia, incluso en pacientes internados en unidades de cuidados intensivos (UCI). Entre los distintos grupos se observó, con variaciones en cada país, un mayor uso de azitromicina, doxiciclina, hidroxicloroquina, levofloxacina y ceftazidima-avibactam. El mayor uso de estos fármacos se evidenció en la primera ola de casos durante la pandemia (ver Cuadro 2).1
Conclusiones
• El uso de agentes antimicrobianos se incrementó durante la pandemia por COVID-191
• Se observó gran heterogeneidad en los hábitos de prescripción en los distintos países evaluados
• El uso de algunos agentes antimicrobianos fue mayor durante la pandemia, y se observó una correlación positiva con las olas de la enfermedad2
Referencias
1. Datos oficiales recabados por Our World in Data – https://OurWorldInData.org/coronavirus
2. Farzana, R. et al. Have antimicrobials been appropriately used in the COVID-19 pandemic? April 15, 2023. Data no publicada presentada en el ECCMID 2023.
Plazo de inicio de antimicrobianos: un nuevo indicador de calidad y proceso
Ramzy Helou MD, estudiante de Ph. D.
Departamento de Microbiología Médica y Enfermedades Infecciosas
Erasmus MC
Rotterdam, Países Bajos
Muchos estudios indican que hay beneficios en la disminución del plazo de inicio de los antibióticos, especialmente en casos de sepsis1. Algunos estudios aún están en proceso.
No está definida una hora de oro para su inicio, y este tema constituye un campo de estudio para la meningitis bacteriana y la neumonía de la comunidad. En casos de sepsis, las guías internacionales recomiendan indicar antibióticos dentro de la primera hora2.
Si hay celeridad para la indicación de antibióticos dentro de la primera hora, surge la posibilidad de la prescripción incorrecta frente a la falta de confirmación del diagnóstico y del momento de inicio de la infección. Es por esto que podemos considerar dos momentos: el inicio de la enfermedad hasta que se indicó el antimicrobiano y el momento desde que se indicó el antimicrobiano hasta que se inició su administración3.
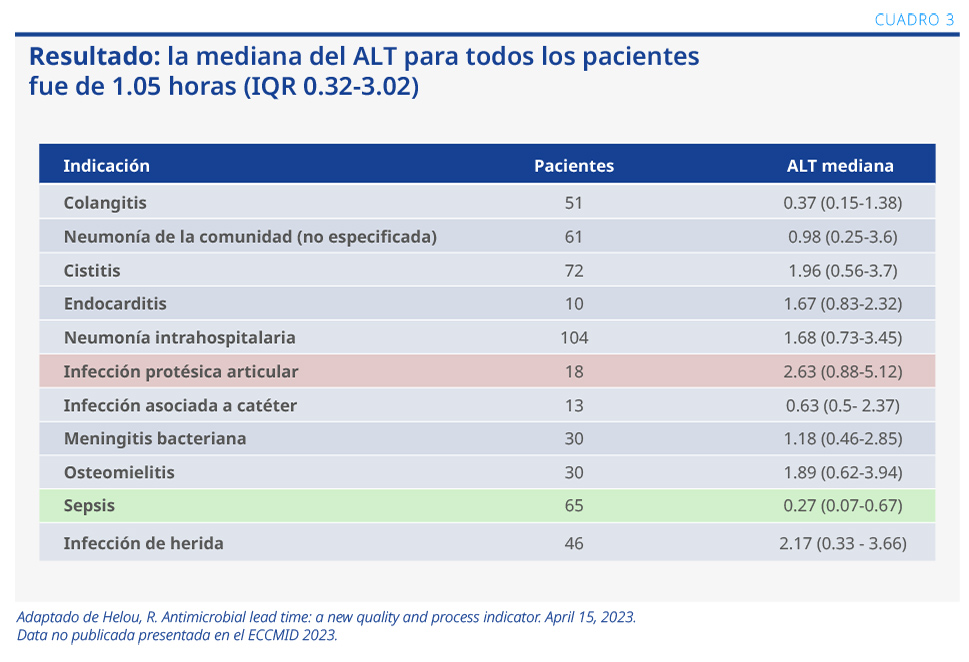
Para el análisis de este nuevo indicador, se diseñó un estudio retrospectivo, unicéntrico, en población adulta hospitalizada que recibió tratamiento antimicrobiano durante un período de 20 meses. El objetivo fue determinar el plazo desde que se indicó el antimicrobiano hasta que se inició su administración (antimicrobial lead time, ALT) y establecer su valor como indicador de la calidad de la atención.
Objetivo primario: determinar el ALT en enfermedades infecciosas. Objetivo secundario: establecer la diferencia de ALT entre sepsis y otras enfermedades infecciosas, pacientes con cultivos positivos vs. negativos, emergencia vs. internación, pacientes recientemente ingresados vs. internación prolongada, y departamento médico vs. departamento quirúrgico.
Se utilizaron los datos de la historia clínica electrónica de 1000 pacientes, 561 hombres y 439 mujeres, con una media de edad de 61 años (ver Cuadro 3).4
Conclusiones
• El ALT es un dato fácil de obtener como indicador de calidad en el abordaje de la sepsis y como indicador de proceso en todas las infecciones.
• Aún se necesitan más estudios para establecer un ALT óptimo.
Referencias
1. Liu VX, et al. The Timing of Early Antibiotics and Hospital Mortality in Sepsis. Am J Respir Crit Care Med. 2017 Oct 1;196(7):856-863.
2. Seymour CW, et al. Time to Treatment and Mortality during Mandated Emergency Care for Sepsis. N Engl J Med. 2017 Jun 8;376(23):2235-2244.
3. Im Y, et al. Time-to-antibiotics and clinical outcomes in patients with sepsis and septic shock: a prospective nationwide multicenter cohort study.Crit Care. 2022 Jan 13;26(1):19.
4. Helou R, et al. Antimicrobial lead time: a new quality and process indicator. April 15, 2023. Data no publicada presentada en el ECCMID 2023.
Contribución de las enfermeras en la administración de antimicrobianos: en búsqueda de la integración de la práctica clínica
Maria Bos, RN
Avans University of Applied Sciences
Breda, Países Bajos
En los últimos años, se incrementaron las publicaciones sobre la contribución de la enfermería para la administración adecuada de antimicrobianos.1
En los Países Bajos se desarrolló un interesante estudio que se planteó detectar las percepciones y opiniones de las enfermeras de internación sobre el rol del uso apropiado de antimicrobianos. El estudio tuvo un diseño cualitativo y fue exploratorio. Utilizó entrevistas como instrumento de obtención de información. Se incluyeron 14 entrevistas (13 mujeres, 50% trabajadores de sala quirúrgica).1
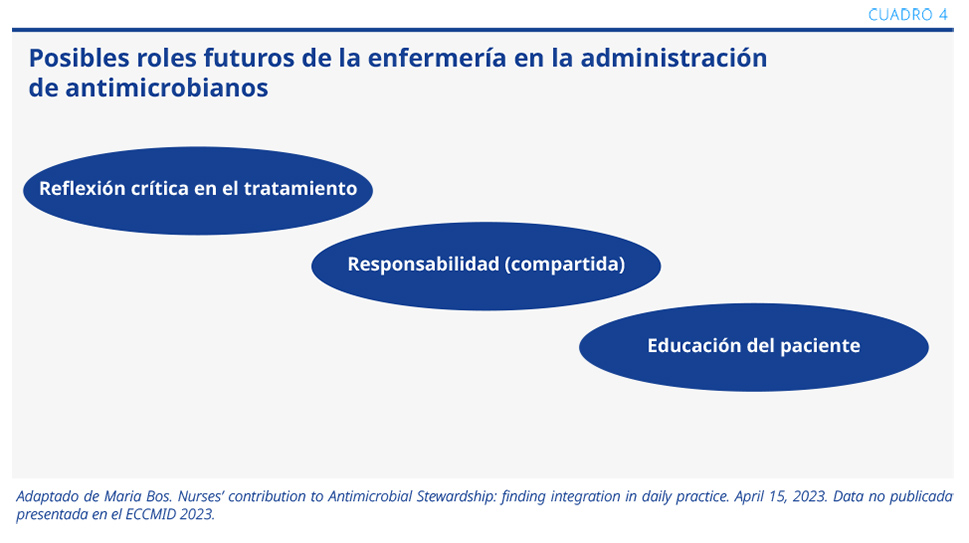
Las enfermeras entrevistadas destacaron que su papel en el proceso de utilización de antimicrobianos en la internación puede ser un factor continuo de intervención. Por ejemplo, pueden actuar alertando al prescriptor sobre aspectos específicos o motivando conductas (cambio de posología endovenosa a oral). Otra función importante es la educación del paciente sobre la toma de antimicrobianos en la internación y al momento del alta.
A continuación, se muestran los pilares del rol que deberían tener en el futuro las enfermeras en el manejo de antimicrobianos, según las reflexiones colectadas en el estudio cualitativo (ver Cuadro 4).1
Para optimizar el rol de la enfermería, es muy importante la educación profesional, el desarrollo de instrumentos que permitan un mejor control, y la clarificación de roles y responsabilidades.
Conclusiones
• En el estudio de investigación, las enfermeras expresaron que pueden contribuir al uso apropiado de antimicrobianos
• Clarificar y compartir responsabilidades entre los prescriptores y las enfermeras puede favorecer el desarrollo de los roles de la enfermería.
Referencias
1. Bos M, et al. Nurses' contribution to antimicrobial stewardship: finding integration in daily practice. April 15, 2023. Data no publicada
presentada en el ECCMID 2023.
Monitoreo de la terapia farmacológica antimicrobiana en pacientes adultos en estado crítico
Dr. Paul Williams
University of Queensland Centre for Clinical Research (UQCCR)
The University of Queensland
Brisbane, Queensland, Australia
Los pacientes en estado crítico con infecciones severas han demostrado tener alteraciones en la PK de los agentes antimicrobianos. El uso de dosificación habitual de las terapias antimicrobianas en estos pacientes pone en riesgo el éxito terapéutico, ya que presentan una respuesta en general inadecuada, comparada con la de la población general.1 Por consiguiente, en la actualidad, se recomienda el monitoreo terapéutico farmacológico de las terapias antimicrobianas en pacientes críticos. Esto ha demostrado disminuir la toxicidad de los fármacos y volver más propicias las condiciones terapéuticas1. Si bien existen guías de recomendación, aún no queda del todo claro si este monitoreo farmacológico mejora la evolución de los pacientes.2
Se realizó un estudio de corte longitudinal que se evaluó a través de una encuesta global dirigida a médicos de unidades de cuidados intensivos. El objetivo fue que los encuestados describieran, desde su perspectiva, el acceso al monitoreo de la terapia farmacológica (MTF) antimicrobiana, así como su utilización, barreras y valoración clínica en el tratamiento de pacientes adultos con infecciones serias.
Se trató de una encuesta en línea desarrollada por un grupo de expertos. Respondieron 538 profesionales de 409 hospitales y 45 países. El 54% de los países era de ingreso alto, mientras que un 23% era de ingreso mediano alto y el otro 23%, de ingreso mediano bajo y bajo.
Según los encuestados, la estrategia que logró mejor evolución clínica en los pacientes fue el MTF. En segundo lugar, se ubicó el intervalo de dosis y, en tercer lugar, se encontraban las guías de consenso. La última posición fue ocupada por la utilización de software (en países de ingreso alto) (ver Cuadro 5).
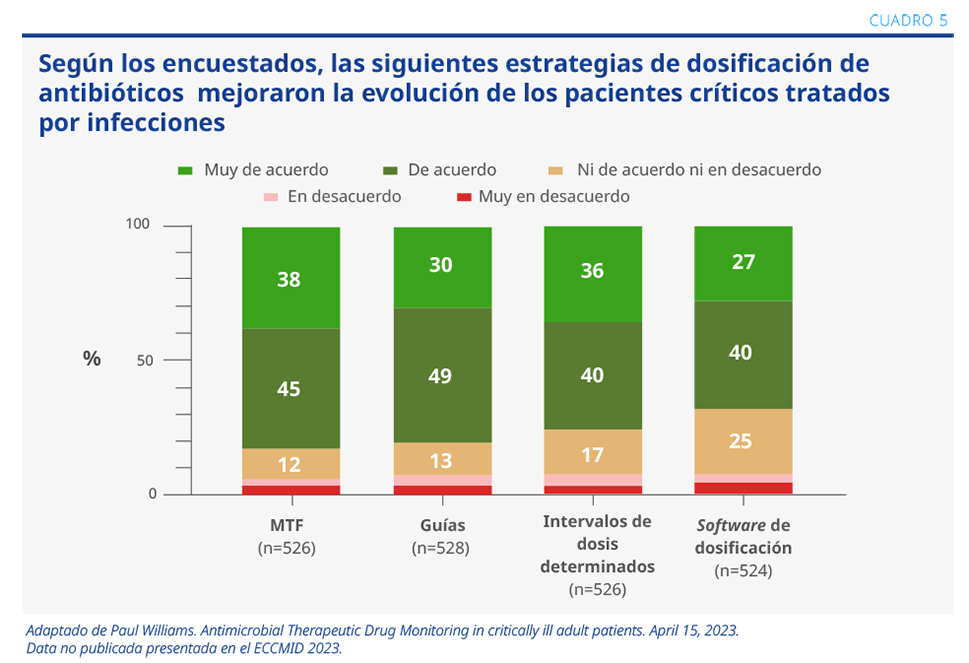
Conclusiones
• Se encontró disparidad geográfica en el acceso clínico a los reportes de monitoreo farmacológico, y en la posibilidad de acceder a cultivos y antibiogramas.
• El 25% de los encuestados de países de ingreso bajo o mediano bajo carecían de desarrollo de cultivos y antibiogramas en su práctica habitual (fundamental para una terapéutica farmacológica antimicrobiana óptima).
• El 21% declaró no tener acceso a vancomicina y el 26%, a aminoglucósidos.
• Fue excepcional la aplicación de software en la práctica clínica para realizar MTF, monitoreo predominantemente utilizado por farmacéuticos.
• Los encuestados consideran que el MTF mejora la evolución de los pacientes infectados internados en unidades de cuidados crónicos, si bien se han identificado importantes barreras para su utilización.
Referencias
1. Craig WA. Basic pharmacodynamics of antibacterials with clinical applications to the use of beta-lactams, glycopeptides, and linezolid. Infect Dis Clin North Am. 2003 Sep;17(3):479-501.
2. Abdul-Aziz MH, et al. Antimicrobial therapeutic drug monitoring in critically ill adult patients: a Position Paper. Intensive Care Med. 2020 Jun;46(6):1127-1153.
Patogénesis de la sepsis, se debe abrazar su complejidad
Dr. Tom van der Poll
Centro de Medicina Molecular y Experimental, División de Enfermedades Infecciosas
Universidad de Ámsterdam. Países Bajos.
La sepsis hoy en día es definida como un estado de disfunción orgánica con riesgo de vida causado por una respuesta desregulada del huésped a una infección.1
La respuesta del huésped a la infección está determinada por la interacción entre las células inmunológicas del huésped y el agente patógeno, en la que se produce la activación de mecanismos proinflamatorios (la liberación de citoquinas, la migración leucocitaria, la activación de complemento y la activación de la coagulación) y la activación de mecanismos antinflamatorios, que buscan evitar el daño colateral de esta respuesta inmunológica. Cuando estos mecanismos se encuentran equilibrados, el sistema inmunológico y por ende el individuo se encuentran en homeostasis, con una respuesta inflamatoria balanceada. Cuando la respuesta está desbalanceada entonces se presenta el estado de sepsis.2
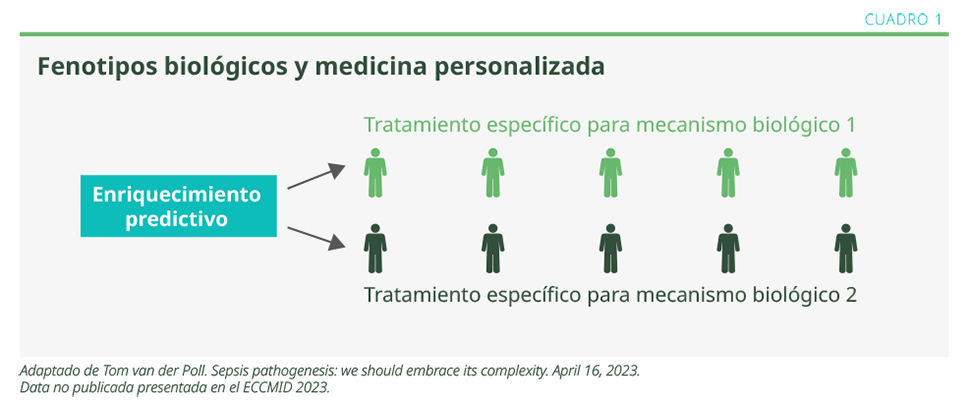
La respuesta séptica en cada paciente es muy heterogénea y es esto lo que se considera la causa por la que los estudios de investigación con fármacos inmunomoduladores administrados en estas situaciones hayan fracasado.3 Hasta la fecha no ha sido posible identificar a los pacientes que potencialmente podrían beneficiarse con estas intervenciones.
Para diseñar estudios en sepsis, se está utilizando, en diversos ensayos, el enriquecimiento por pronóstico, donde se eligen a aquellos pacientes con determinado pronóstico (por ej., pacientes en shock, con insuficiencia cardíaca, insuficiencia renal, etc.), y luego el método de enriquecimiento por predicción (guiado en función de la molécula en estudio y los datos de laboratorio que presenta el paciente). El estudio Scarlet es un buen ejemplo, en el que se eligieron pacientes con insuficiencia cardíaca y/o respiratoria (enriquecimiento por pronóstico) y, de estos, a los que tuvieran coagulopatía asociada a la sepsis, bajas plaquetas, RIN* >1.4 (enriquecimiento predictivo) se les administró inmunomodulina (ver Cuadro 1).3
*RIN: Razón Internacional Normatizada.
Actualmente, se encuentran diversos estudios que investigan la forma en que, basado en un sistema computarizado, se pueda definir el pronóstico de un paciente séptico en función de su endotipo leucocitario. Un estudio basado en características genómicas del ARNm leucocitario encontró 4 endotipos asociados cada uno con diferente pronóstico y mecanismos fisiopatológicos de la sepsis.4
Se necesita integrar en tiempo real la información espacio dinámica de la respuesta inmunológica del paciente y asociarla a una herramienta que permita la decisión clínica. El diseño de esta herramienta podría ser similar a los mecanismos utilizados actualmente por los meteorólogos para predecir el clima y los cambios climáticos. En este caso, basado en modelos matemáticos asociados a los datos del paciente, se podría pronosticar la posibilidad de respuesta de un paciente a una determinada terapia y calcular su pronóstico.5
Conclusiones
• La sepsis es un estado altamente complejo, de evolución no lineal y con cambios espacio temporales.
• La complejidad de la sepsis no puede evaluarse en un determinado momento, sino que debe hacerse a nivel longitudinal temporal y con una recolección continua de datos biológicos.
• Para comprender esta complejidad, deberán integrarse sistemas computarizados junto con datos biológicos con el objetivo de pronosticar el rumbo del cuadro clínico séptico del paciente.
Referencias
1. Singer M, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016 Feb 23;315(8):801-10.
2. van der Poll T, Shankar-Hari M, Wiersinga WJ. The immunology of sepsis. Immunity. 2021 Nov 9;54(11):2450-2464.
3. Vincent J, et al. Effect of a recombinant human soluble thrombomodulin on mortality in patients with sepsis-associated coagulopathy: The SCARLET Randomized Clinical Trial. JAMA. 2019;321(20):1993–2002.
4. Scicluna BP, et al. Classification of patients with sepsis according to blood genomic endotype: a prospective cohort study. Lancet Respir Med.2017 Oct;5(10):816-826.
5. Schuurman AR, Sloot PMA, Wiersinga WJ, van der Poll T. Embracing complexity in sepsis. Crit Care. 2023 Mar 11;27(1):102.
Mejoras en el diagnóstico de la sepsis
Brigitte Lamy
Laboratorio de Bacteriología, Hospital L’Archet2. Niza, Francia
Equipo de Virulencia Microbiana y Señalización Inflamatoria, INSERM U1065,
Universidad Côte d’Azur
Consejo de Investigación Médica del Centro de Bacteriología Molecular e Infectología, Imperial College London
Londres, Inglaterra.
En la sepsis se distingue una población heterogénea de pacientes y el tiempo de inicio de tratamiento antimicrobiano apropiado es determinante para los resultados de mortalidad.1 Mejorar el tiempo hasta el diagnóstico es un objetivo prioritario.
Las estrategias disponibles para este objetivo son la utilización de biomarcadores, inteligencia artificial (IA) y estudios microbiológicos.
Actualmente, están en estudio nuevos biomarcadores, como la distribución morfológica de monocitos (MDW), especialmente para la sepsis en situaciones con bajo pretest, en casos en los que no fueron medidos la procalcitonina y el micro ARN circulante, sin diferencias significativas con procalcitonina y con elevada heterogeneidad, según el tipo de muestra y el miARN medido. Los marcadores endoteliales, como el Syndecan-1 y la trombomodulina soluble (sTM), se utilizan para determinar la gravedad y predecir la incidencia de sepsis en la población de cuidados intensivos.2
Se identificó que la IA, a través de algoritmos de machine learning, predice el inicio de la sepsis horas antes que los métodos convencionales aplicados por médicos. También se observó mejor predicción del riesgo en pacientes con diagnóstico de sepsis y de los falsos positivos en los pacientes sin sepsis, pero con riesgo de tenerla (ver Cuadro 2).3
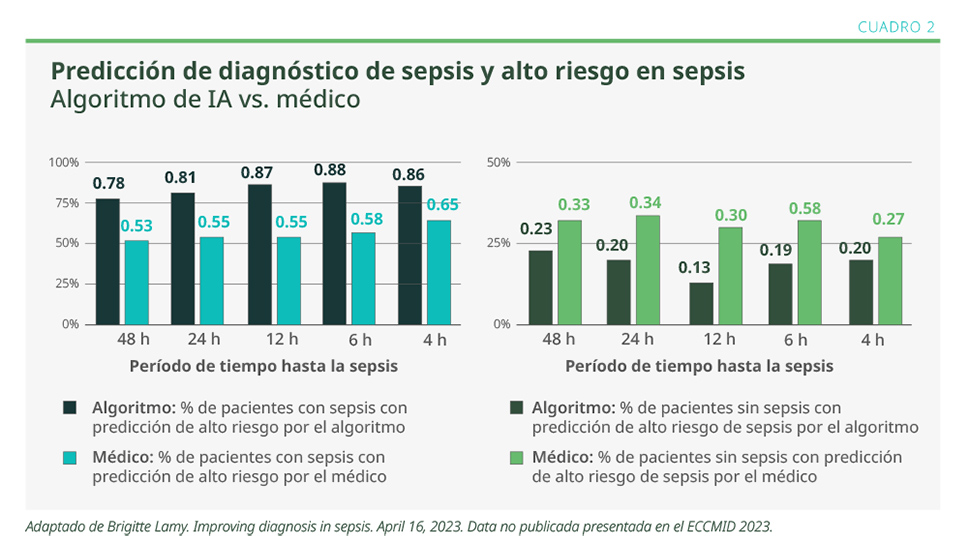
Otro método en estudio es la determinación métrica polivalente del mARN, con el objetivo de evaluar el rendimiento diagnóstico y pronóstico en pacientes que ingresan a emergencias o a la unidad de cuidados críticos. Realiza una cuantificación rápida de la expresión del mARN de los genes objetivo, determinando una cuantificación de riesgo basada en un algoritmo de machine learning.4
Con respecto al diagnóstico microbiológico, los hemocultivos son el método estándar, pero resultan lentos e imperfectos. Es por esto que están en desarrollo e investigación los métodos independientes de cultivos.5 Los paneles de diagnóstico molecular por T2MRI en infecciones sanguíneas logran un diagnóstico en pocas horas. Las limitantes son que tienen una escasa variedad de patógenos a diagnosticar, son costosos, aun no detectan resistencia antimicrobiana y tienen escasa validación en estudios a gran escala.6 Otros ejemplos son las técnicas de reacción en cadena de la polimerasa por gota digital (ddPCR), que se muestran como una técnica más sensible que la PCR a tiempo real (qPCR), lo cual permite una cuantificación absoluta del ADN de organismos en muestras de sangre, y el nanodiagnóstico.7
Conclusiones
• Falta desarrollar métodos rentables y rápidos.
• Hay tecnología prometedora disponible y en desarrollo, de la cual se requieren más datos clínicos.
• Se necesita un diagnóstico etiológico y de respuesta del paciente más rápido.
• Se necesitan más y mejores estudios clínicos.
• Se requiere un mejor manejo de la heterogeneidad de las variables de los pacientes en las estrategias terapéuticas.
Referencias
1. Cecconi M, Evans L, Levy M, Rhodes A. Sepsis and septic shock. Lancet. 2018 Jul 7;392(10141):75-87
2. Zhou G, et al. Elevated endothelial dysfunction-related biomarker levels indicate the severity and predict sepsis incidence. Sci Rep.2022;12(1);21935.
3. Goh K, et al. Artificial intelligence in sepsis early prediction and diagnosis using unstructured data in healthcare. Nat commun. 2021;12(1);711.
4. Brakenridge SC, et al. Evaluation of a multivalent transcriptomic metric for diagnosing surgical sepsis and estimating mortality among critically ill patients. JAMA Network Open. 2022;5(7);e2221520-e2221520.
5. Peri A, et al. Culture-independent detection systems for bloodstream infection. Clin Microbiol Infect.2022;28:195–201.
6. Giannella M, et al. Antimicrobial and resource utilization with T2 magnetic resonance for rapid diagnosis of bloodstream infections: systematic review with meta-analysis of controlled studies, Expert Review of Medical Devices. 2021;18:5;473-482.
7. Wu J, et al. Clinical validation of a multiplex droplet digital PCR for diagnosing suspected bloodstream infections in ICU practice: a promising diagnostic tool. Crit Care.2022;26(1), 243.
Desafíos en el manejo de la sepsis en los países de ingreso bajo y mediano
Dra. Flavia Machado
Profesora de Cuidados Intensivos y Presidenta de la Sesión de Cuidados
Intensivos del Departamento de Anestesiología, Dolor y Cuidados Intensivos de la Universidad Federal de São Paulo
São Paulo, Brasil
La sepsis genera alto impacto en los países de ingreso bajo y mediano, donde se reportaron 11 millones de muertes por esta causa en 2017. La sepsis representó el 19.7% de todos los fallecimientos en estos países.1 Las variables sociales y demográficas son determinantes para entender estos datos.
Con el objetivo de optimizar el manejo de los pacientes con sepsis en los países de ingreso bajo y mediano, están desarrollándose una serie de acciones (ver Cuadro 3).2

En Brasil, la mortalidad por sepsis es muy elevada en los adultos (55%)3 y en los pacientes pediátricos (19.8%).4 Por este motivo, al igual que en otros países de similares niveles de ingreso, resulta esencial actuar con miras a reducir estas tasas de letalidad.
Uno de los aspectos esenciales para mejorar el reconocimiento de la sepsis es la formación profesional, tanto de los médicos como del personal de enfermería.2 El rol de enfermería puede ser importante en el reconocimiento de la sepsis.
La infraestructura influye en los resultados de supervivencia en Brasil. Un estudio de investigación demostró que, en los hospitales públicos, es alto el porcentaje de pacientes que permanecen en los servicios de emergencias. En consonancia, la proporción de fallecidos en este grupo es elevada.5 Además, la derivación a otro centro asistencial diferente al de la atención inicial es un factor de riesgo de muerte.5
Conclusiones
• Los principales desafíos del manejo de la sepsis en los países de ingreso bajo y mediano son: perfeccionar las estrategias de prevención, optimizar la administración y el inicio de la antibioticoterapia, potenciar las investigaciones y mejorar la implementación de programas en el área.
• El mayor desafío radica en superar las disparidades sociales en los países de ingreso bajo y mediano.
Referencias
1. Rudd KE, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study. Lancet. 2020 Jan 18;395(10219):200-211.
2. Machado F, et al. Sepsis management in low and middle-income countries. April 16, 2023. Data no publicada presentada en el ECCMID 2023.
3. Machado FR, et al; SPREAD Investigators; Latin American Sepsis Institute Network. The epidemiology of sepsis in Brazilian intensive care units (the Sepsis PREvalence Assessment Database, SPREAD): an observational study. Lancet Infect Dis. 2017 Nov;17(11):1180-1189.
4. De Souza DC, et al. The epidemiology of sepsis in paediatric intensive care units in Brazil (the Sepsis PREvalence Assessment Database in Pediatric population, SPREAD PED): an observational study. Lancet Child Adolesc Health. 2021 Dec;5(12):873-881.
5. Machado FR, y col. Sepsis in Brazilian emergency departments: a prospective multicenter observational study. Intern Emerg Med. 2023 Mar;18(2):409-421.
Administración de antibióticos en la unidad de cuidados intensivos: cuáles son las mejores prácticas en la era de la resistencia a antibióticos
Dr. Jan J. De Waele
Presidente electo de ESICM. Profesor de la Universidad de Gante. Intensivista del Hospital Universitario de Gante.
Investigador clínico senior de Research Foundation–Flanders
Bélgica.
La administración de antibióticos en la Unidad de Cuidados Intensivos (UCI) tiene particularidades que devienen de cuantiosos factores. Uno de ellos está relacionado con el tipo de paciente, con frecuencia, poseedor de múltiples comorbilidades, inmunocomprometido, o cursando cuadros clínicos de riesgo de vida o edad avanzada. Otro factor importante son las modificaciones farmacocinéticas de los medicamentos, por ejemplo, relacionadas con la falla renal o hepática.1 Además, las infecciones suelen presentar mayor gravedad. Numerosos factores contribuyen al desarrollo de resistencia antimicrobiana: duración de la internación, edad avanzada, comorbilidades, exposición a antimicrobianos y los procedimientos invasivos.2 Un factor de peso es la sobreindicación de los prescriptores por diversos motivos. Se destacan, entre ellos, el diagnóstico erróneo ante las múltiples condiciones que pueden simular una sepsis (“miedo a no diagnosticar una sepsis”).
Varios estudios mostraron que el 70% de los pacientes internados en la UCI reciben antibióticos, pero, de ellos, de un 30 a un 60%3 tienen indicación inapropiada, innecesaria o subóptima.4
El estudio DIANA aporta valiosa información sobre el manejo de los antibióticos en la UCI. Solo el 60% de los centros participantes tienen guías locales de manejo de antibióticos. El porcentaje de desescalamiento de la terapia fue bajo (16%) y la duración de la terapia, prolongada (ver Cuadro 1).5
Es muy importante reducir la exposición a antibióticos para evitar la resistencia y alcanzar mejores resultados clínicos sin elevación excesiva de los costos. Para ello, es esencial el trabajo multidisciplinario. Enfermería puede tener un rol muy importante para lograr el correcto uso de los antibióticos.2

Conclusiones
• El uso de antibióticos en la UCI es demasiado alto.
• Hay fallas en la aplicación de principios racionales para la administración de antibióticos.
• Se necesitan programas universales para optimizar el uso de antibióticos.
Referencias
1. Roberts JA, et al. On behalf of The International Society of Anti-Infective Pharmacology (ISAP) and the PK/PD Study Group of the European Society of Clinical Microbiology and Infectious Diseases (ESCMID). Individualised antibiotic dosing for patients who are critically ill: challenges and potential solutions. Lancet Infect Dis. 2014 Jun;14(6):498-509.
2. De Waele, JJ. AMS in the ICU. What is the best practice in the era of AMR. April 17, 2023. Data no publicada presentada en el ECCMID 2023.
3. Luyt CE, et al. Antibiotic stewardship in the intensive care unit. Crit. Care. 2014 Aug 13;18(5):480.
4. Vincent JL, et al; EPIC III Investigators. Prevalence and Outcomes of Infection Among Patients in Intensive Care Units in 2017. JAMA. 2020 Apr 21;323(15):1478-1487.
5. De Bus L, et al; DIANA study group. Antimicrobial de-escalation in the critically ill patient and assessment of clinical cure: the DIANA study.
Intensive Care Med. 2020 Jul;46(7):1404-1417.
Caso clínico: infección por gram negativos multirresistentes
Dra. Evelina Taconell
Enfermedades infecciosas, Unidad de Investigación
Universidad de Verona, Italia.
Paciente de 67 años
• Antecedentes de hipertensión, diabetes tipo 2 e insuficiencia renal crónica.
• Marzo 2023: adenocarcinoma de páncreas (estadio IIB).
• 29/03: se realiza cirugía de cabeza de páncreas y duodenectomía. Se colocan acceso venoso central y sonda vesical.
• Profilaxis con cefazolina; se tomaron muestras intraoperatorias para cultivo.
• 03/04: síntomas de compromiso general, abdomen agudo, fiebre. Se toman hemocultivos y se encuentran 2 abscesos intraabdominales contiguos al páncreas remanente. Se inicia tratamiento con meropenem, se decide no operar.
• 9.o día posoperatorio: aislamiento de Klebsiella pneumoniae productora de KPC (carbapenemasa) en hemocultivos y cultivos de material intraabdominal: bacteriemia posoperatoria secundaria a infección del sitio quirúrgico. Se rota tratamiento antibiótico a tratamiento dirigido al patógeno aislado.
• A los 3 días: shock e insuficiencia respiratoria, pasa a unidad de cuidados intensivos (UCI) y al día 15 posoperatorio vuelve a sala general.
Discusión
¿Qué se sugiere en prevención?]
Retirar lo antes posible la sonda vesical. Hay evidencia de que, a mayor cantidad de días de sonda, mayor riesgo de infección en el punto de partida urinario. Se sugiere, si no hay indicación, retirarla antes del 5.o día.1 Asimismo, es recomendable hacer el screening para evaluar la colonización del paciente en lugares donde se sabe que hay alto riesgo de colonización de la población por determinados gérmenes y es fundamental saber qué hacer con el resultado. Este paciente fue evaluado, se aisló Klebsiella productora de KPC, pero no fue usado el antibiótico adecuado para la profilaxis. Por último, pero no menos importante, extremar las medidas de prevención de contacto por parte del equipo de salud.
A nivel hospitalario, es fundamental generar rápidos mecanismos de desarrollo de guías basadas en la epidemiología local y facilitar el acceso de tests diagnósticos y de antibióticos adecuados, que pueden variar en gran medida entre los diferentes países. Hoy en día, hay evidencia que sugiere el uso de tests rápidos moleculares en casos de sepsis, con el objetivo de aislar el microorganismo resistente lo más rápidamente posible y administrar el tratamiento antibiótico adecuado en el menor tiempo posible, para así disminuir la mortalidad (ver Cuadro 2).2
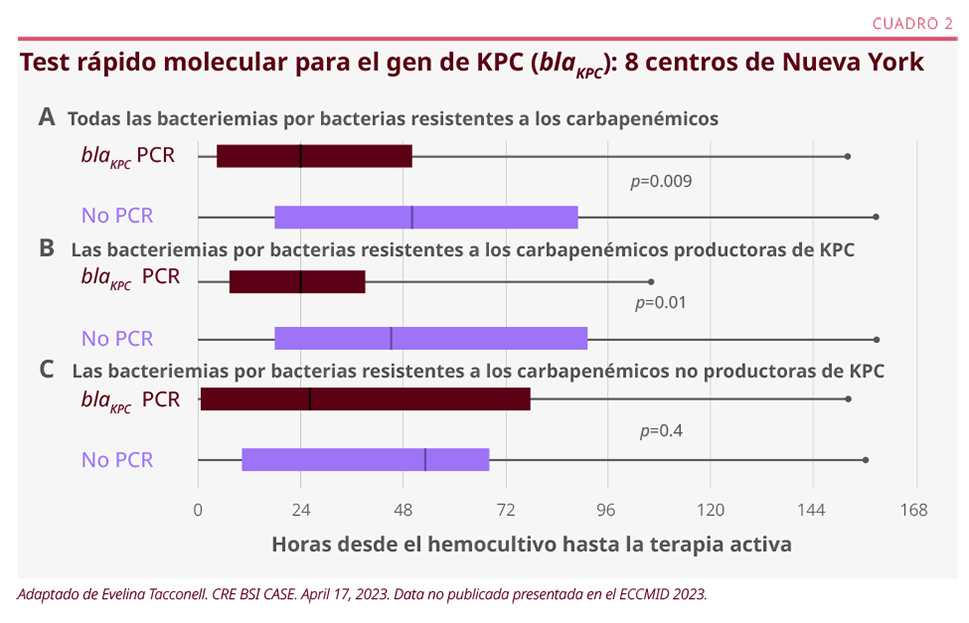
Conclusiones
• Evaluar los factores de riesgo del paciente, testear para detectar gérmenes resistentes y administrar una adecuada profilaxis.
• Optimizar la prevención de la transmisión hospitalaria, entrenar al equipo de salud en estas transmisiones, vigilar la adherencia del paciente, y realizar monitoreo de las infecciones y del registro epidemiológico.
• Disponer de tests de diagnósticos rápidos antes de las cirugías y para infecciones sistémicas.
• Estandarizar la terapia antibiótica, desarrollar terapias dirigidas y determinar los gérmenes prevalentes en cada ámbito.
Referencias
1. McIntosh S, et al. Timing of urinary catheter removal after colorectal surgery with pelvic dissection: A systematic review and meta-analysis. Ann Med Surg (Lond). 2021 Dec 13;73:103148. doi: 10.1016/j.amsu.2021.103148. PMID: 34976383; PMCID: PMC8685994.
2. Satlin MJ, et al. Impact of a rapid molecular test for Klebsiella pneumoniae carbapenemase and ceftazidime-avibactam use on outcomes after bacteremia caused by carbapenem-resistant enterobacterales. Clin Infect Dis. 2022 Dec 19;75(12):2066-2075.
Pseudomonas aeruginosa resistente a carbapenémicos e infecciones complicadas del tracto urinario
Jesús Rodríguez Baño
Unidad de Enfermedades Infecciosas y Microbiología
Hospital Universitario Virgen Macarena
Departamento de Medicina, Universidad de Sevilla
España
Caso clínico 1
• Mujer de 75 años, residente en un hogar para la tercera edad.
• Antecedentes de Parkinson y diabetes mellitus.
• Cuatro internaciones en el año previo por infección del tracto urinario (ITU). Se asumió ITU por urocultivos positivos y agitación. Recibió fosfomicina, nitrofurantoína, cefuroxima y ciprofloxacina.
• Quinta internación por fiebre y disuria. Urocultivo positivo para E. coli productora de betalactamasa. Se administran 5 días de meropenem y 5 días de ertapenem.
• Dos semanas más tarde, se observa urocultivo de control positivo para Pseudomonas
aeruginosa resistente a carbapenémicos, sin síntomas.
Discusión
En esta paciente, que ya ha recibido múltiples tratamientos antibióticos, se sugiere no tratar, ya que presenta una bacteriuria asintomática. Por otro lado, no queda claro si realmente los cuadros previos fueron de ITU, ya que, en una paciente sin síntomas urinarios con deterioro cognitivo, deterioro funcional y delirium, se debe descartar previamente otra causa de los síntomas y realizar un control clínico estricto antes de administrar un antibiótico.1
Caso clínico 2
• Mujer de 55 años, paro cardíaco por infarto agudo del miocardio (IAM). Luego de la reanimación, queda con bajo nivel de conciencia.
• En el día 8 presenta neumonía asociada al respirador, se aísla P. aeruginosa y recibe imipenem cada 8 h por 10 días.
• A los 16 días ingresa a sala común con sonda nasogástrica, catéter y sonda vesical.
• En el día 20 presenta fiebre y piuria. Se aísla P. aeruginosa resistente a imipenem en hemo y urocultivos.
Discusión
La medida más eficaz para disminuir el riesgo de infección en esta paciente habría sido remover la sonda vesical, salvo que tuviera una clara indicación para ella, y recordar que siempre que se coloca un catéter debe ser con medidas absolutamente asépticas. P. aeruginosa es una bacteria con susceptibilidad reducida a los betalactámicos, con variados mecanismos de producción de resistencia y alto riesgo de clones de resistencia asociados.2 Cuando se le administra un betalactámico a un paciente con P. aeruginosa, tenemos que tener presente que hay un alto riego de generar mutaciones bacterianas y, por ende, resistencia.
Caso clínico 3
• Mujer de 52 años con esclerosis múltiple y vejiga neurogénica.
• Luego de una hemicolectomía por adenocarcinoma de colon presenta peritonitis y se le administra meropenem durante 7 días.
• En el día 10 se aísla P. aeruginosa multirresistente (MR). El alta hospitalaria se produce en el día 20.
• Tres semanas después, presenta disuria y piuria con aislamiento de P. aeruginosa MR en orina.
Discusión
Hoy en día se encuentran disponibles diversos antibióticos para tratar infecciones por P. aeruginosa productora de carbapenemasas. En pacientes de bajo riesgo, se ha sugerido que el uso de altas dosis de antibióticos más antiguos podría ser igualmente eficaz.3
Conclusiones
• Para la prevención de ITU: evitar la sonda vesical si no es estrictamente necesaria. De tener indicación para ella, evitar removerla frecuentemente e intensificar los cuidados básicos.
• Para la prevención de P. aeruginosa: evitar el sobreuso de antibióticos para evitar la resistencia secundaria y asegurar las medidas de higiene del personal de salud para evitar la transmisión entre pacientes.
• Evitar los urocultivos de rutina e innecesarios.
• No tratar las bacteriurias asintomáticas, excepto pocas excepciones.
• Pensar en el futuro del paciente y no indicar un tratamiento antibiótico de no mediar una clara indicación.
• Utilizar las dosis de antibiótico apropiadas y tratar durante el menor tiempo posible.
Referencias
1. Nicolle LE, et al. Clinical practice guideline for the management of asymptomatic bacteriuria: 2019 update by the Infectious Diseases Society of America. Clin Infect Dis. 2019 May 2;68(10):e83-e110.
2. Horcajada JP, et al. Epidemiology and treatment of multidrug-resistant and extensively drug-resistant Pseudomonas aeruginosa infections. Clin Microbiol Rev. 2019 Aug 28;32(4):e00031-19
3. Paul M, et al. European Society of Clinical Microbiology and Infectious Diseases (ESCMID) guidelines for the treatment of infections caused by multidrug-resistant Gram-negative bacilli (endorsed by European society of intensive care medicine). Clin Microbiol Infect. 2022 Apr;28(4):521-547.
2022-2023 Actualización de la lista de la Organización Mundial de la Salud (OMS) de patógenos bacterianos prioritarios
Dr. Hatim Sati
Director de proyecto, Unidad de Coordinación de Impacto,
Iniciativas e Investigación
Departamento de Coordinación Global de Resistencia Antimicrobiana
División de Resistencia Antimicrobiana
OMS
La incidencia de resistencia antimicrobiana (AMR) está en aumento, y es un problema de salud pública global, que genera millones de muertes atribuibles y asociadas a este fenómeno.1
Teniendo en cuenta esta situación, en 2015, se publicó y fue adoptado por la OMS el Plan Global de Acción para la Resistencia Antimicrobiana con el objetivo de reducir la incidencia de infecciones, optimizar el uso de antimicrobianos, mejorar el entendimiento de la situación y fortalecer el conocimiento por medio de la vigilancia y la investigación.2
Luego de adoptar este Plan, en 2017 se definió la primera lista de patógenos bacterianos para los cuales priorizar la inversión en investigación y desarrollo de nuevos antibióticos. Se destacaron 13 patógenos bacterianos, así como la tuberculosis. Las bacterias resistentes a los antibióticos en la lista de prioridades se clasificaron en tres niveles: crítica, alta y media.3 Desde su publicación, se han lanzado al mercado 7 antimicrobianos nuevos para microorganismos priorizados.
La idea de actualizar esta lista surge de la publicación de evidencia nueva y datos con respecto a la resistencia antimicrobiana, la oportunidad de direccionar limitaciones y aplicar lecciones aprendidas.
Se utilizó una metodología de análisis por decisiones multicriterio, que permitió revisar en conjunto con la evidencia actualizada los criterios de inclusión, otorgándoles un peso relativo, al evaluarlos en conjunto con los patógenos y realizar un score de jerarquización final.
Por último, si bien la lista anterior estaba basada en la evidencia, los vacíos en ella generaron que hubiera más peso de la experiencia y, por esa razón, hubiera mayor cantidad de criterios cualitativos. La lista presenta 4 criterios cuantitativos y 4 cualitativos (ver Cuadro 3).

Conclusiones
• Luego de la generación de un Plan Global de Acción contra la resistencia microbiana en 2017, la OMS confeccionó una lista de patógenos prioritarios que ha tenido gran impacto en el desarrollo de antibióticos, algunos de los cuales hoy ya se encuentran disponibles.
• La actualización de esta lista tiene mayor peso respecto de la evidencia publicada y se utilizaron para su realización metodologías comparativas y de toma de decisión múltiple.
Referencias
1. Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet. 2022 Feb 12;399(10325):629-655.
2. World Health Organization. WHO Global Action Plan on AMR 2015. Disponible en https://apps.who.int/iris/rest/bitstreams/864486/retrieve
3. World Health Organization. WHO Bacterial Priority Pathogen List. Disponible en: http://remed.org/wp-content/uploads/2017/03/lobal-priority-list-of-antibiotic-resistant-bacteria-2017.pdf
Evidencia para la individualización de la dosis: dónde estamos en 2023
Farm.a Birgit Koch, Ph. D
Farmacéutica de hospital, Farmacóloga clínica y Profesora]
Erasmus MCP
aíses Bajos.
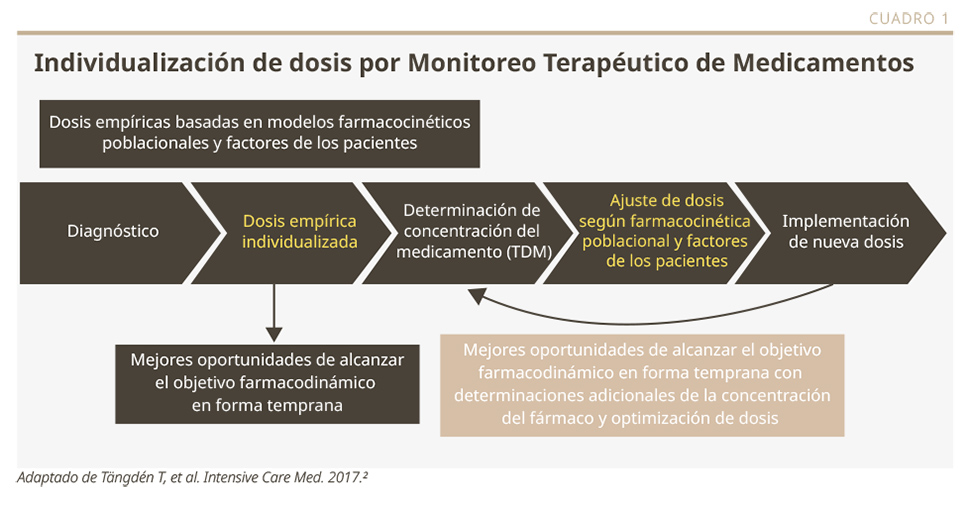
La individualización de la dosis de antibióticos tiene como objetivo reducir la toxicidad e incrementar la eficacia terapéutica.1 Este aspecto es esencial en determinadas poblaciones de pacientes, tanto los más vulnerables como aquellos que presentan falla renal, las embarazadas o los enfermos críticos.1 Una de las estrategias interesantes para obtener la individualización de dosis es el Monitoreo Terapéutico de Medicamentos (TDM, por sus siglas en inglés), cuyo funcionamiento se describe en detalle en el Cuadro 1.2
En 2023 se publicó una interesante revisión sistemática y metaanálisis, donde se evaluó la eficacia de los modelos de individualización de dosis (TDM o MIPD, por sus siglas en inglés; MIPD: dosificación de precisión basada en modelos) con relación al abordaje estándar. En el metanálisis se incluyeron diez ensayos aleatorizados.3 No se encontraron diferencias en la mortalidad entre ambas estrategias, aunque los modelos de individualización de dosis mostraron beneficios respecto del objetivo de alcanzar una dosis precisa de la antibioticoterapia.3
Conclusiones
• Los modelos de individualización de dosis (TDM, MIPD) son herramientas válidas que pueden utilizarse para aumentar la eficacia de la terapia antibiótica y reducir la toxicidad. Por ello, las poblaciones de pacientes vulnerables (embarazadas, pacientes con comorbilidades o de gravedad clínica) son las más beneficiadas.
• El conocimiento del área está en pleno desarrollo. Las herramientas tecnológicas permitirán perfeccionar los modelos y abrir nuevos caminos para alcanzar la mejor terapia individualizada.
Referencias
1. Koch B. Evidence for dose individualisation. April 18, 2023. Data no publicada presentada en el ECCMID 2023.
2. Tängdén T, et al. The role of infection models and PK/PD modelling for optimising care of critically ill patients with severe infections. Intensive Care Med. 2017 Jul;43(7):1021-1032.
3. Codina MS, et al. Individualised antimicrobial dose optimisation: a systematic review and meta-analysis of randomised controlled trials. Clin Microbiol Infect. 2023 Mar 23:S1198-743X(23)00134-9.
Monitoreo terapéutico de medicamentos: un panorama a 5 años
Dra. Sophie Stocker
Escuela de Farmacia, Facultad de Salud y Medicina,
Universidad de Sídney
Sídney, Australia.
El monitoreo de fármacos se realiza para identificar los factores que hacen que la respuesta sea variable entre individuos y para guiar la optimización de las dosis recomendadas.1 Sin embargo, este control presenta desafíos, ya que los costos son elevados, la obtención de la información es compleja, y se necesita de experiencia en el manejo de los software de predicción.2
En la actualidad, se está priorizando el desarrollo de dispositivos de monitoreo no invasivos, portátiles, que puedan transmitir información a distancia, y que sean operados por el paciente y más económicos. Un ejemplo en investigación y desarrollo son los biosensores, dispositivos pequeños, implantables, que utilizan sensores biológicos para detectar condiciones del medio, procesos/reacciones químicas, monitoreo continuo de las concentraciones de un fármaco y relaciones PK/PD, sin necesidad de extracción sanguínea (ver Cuadro 2).3,4
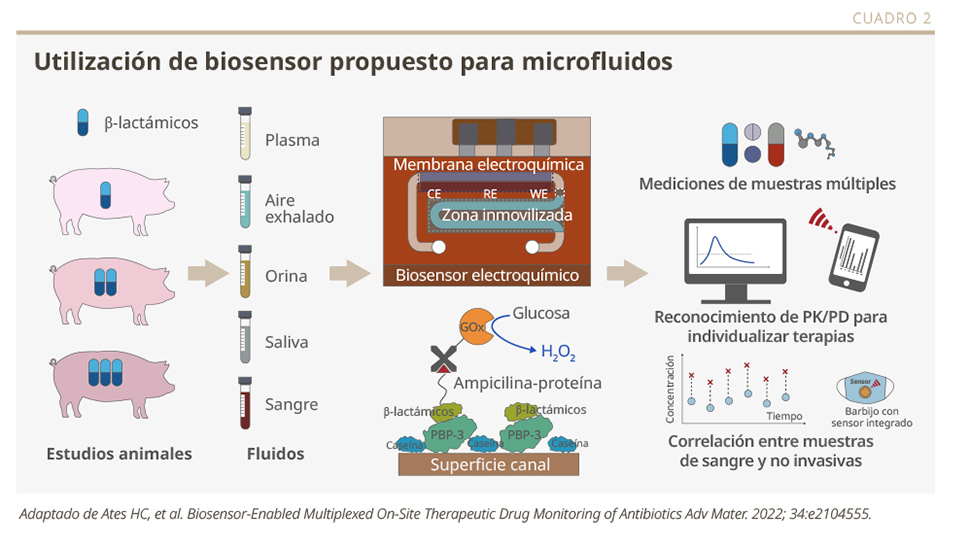
En este sentido, la utilización de biosensores con aptámeros es de vanguardia. Los aptámeros son ácidos nucleicos con secuencias cortas de ADN o ARN monocatenario, seleccionados de acuerdo con su afinidad hacia una molécula diana, para lograr la mejor selectividad y especificidad. Se han utilizado rápidamente en el campo de los sensores como elementos de reconocimiento, debido a sus ventajas con respecto a los anticuerpos, como alta estabilidad, menor tamaño y alta afinidad por moléculas pequeñas. Además, son fáciles de sintetizar in vitro, simples de modificar y flexibles de diseñar. Estas características pueden contribuir a la diversificación de objetivos y mejorar la detección mediante uniones más eficientes.5
Conclusiones
• La monitorización terapéutica de medicamentos es una actividad necesaria, pero presenta muchos desafíos para su desarrollo y análisis de datos
• Los biosensores son una tecnología en investigación que permite crear dispositivos portátiles, de monitoreo continuo para fármacos o procesos específicos, controlados por el paciente
• La tecnología con aptámeros posee ventajas funcionales y estructurales que pueden contribuir a mejorar y diversificar la utilización de biosensores para el monitoreo terapéutico
Referencias
1. Spear BB, et al. Clinical application of pharmacogenetics. Trends in molecular medicine. 2001;7(5):201-204.
2. Stocker SL, et al. Evaluation of a Pilot Vancomycin Precision Dosing Advisory Service on Target Exposure Attainment using an Interrupted Time Series Analysis Clinical Pharmacology & Therapeutics. 2021;109(1):212-221.
3. Ates HC, et al. Biosensor-Enabled Multiplexed On-Site Therapeutic Drug Monitoring of Antibiotics Adv Mater. 2022; 34:e2104555.
4. Ates HC, et al. Non-Invasive Diagnostics: Integrated Devices for Non-Invasive Diagnostics Adv Funct Mater. 2021;5:2170105.
5. Marrazza G. Aptamer Sensors. Biosensors (Basel). 2017 Jan 4;7(1):5.
Optimización de dosis en los programas de administración de antibióticos
Dr. Thomas Tängdén, Ph. D.
Profesor Asociado de Enfermedades Infecciosas de la Universidad de Upsala Suecia
En el hospital se cuenta con tres niveles de dosis óptimas de antibióticos: estándar, grupal e individual.
La dosis estándar se deriva de estudios, en su mayoría en animales o también en grupos heterogéneos de personas, que se realizan utilizando los valores otorgados por EUCAST (Comité Europeo para el Testeo de Susceptibilidad Antimicrobiana).
La dosis grupal tiene en cuenta factores como embarazo, falla renal, peso corporal, edad, etc. Esta dosis es determinada principalmente por la opinión de expertos, ya que no hay suficiente evidencia clínica, lo que genera mucha variabilidad. En estos casos, resultan útiles los modelos de predicción de PK/PD (índices farmacocinéticos y farmacodinámicos).
Los enfermos críticos son un grupo a tener en cuenta, ya que las dosis subóptimas no van a generar buen resultado. En un metaanálisis se evidenció que la infusión continua es una buena estrategia para los betalactámicos. Al igual que con el grupo estándar, las limitaciones son la falta de evidencia clínica.1
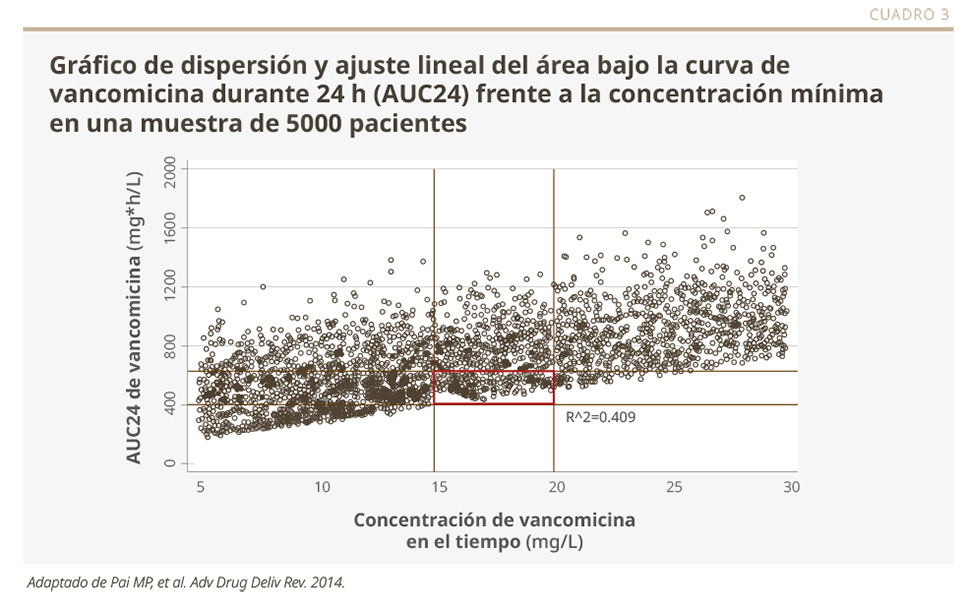
La dosis individualizada deriva de la utilización del Monitoreo Terapéutico de Medicamentos (TDM, por sus siglas en inglés), lo cual reduce el riesgo de toxicidad y de resistencia bacteriana. En estos casos se utilizan datos del paciente, de estudios in vitro y clínicos de PK.2 El beneficio de esta estrategia se observa especialmente en el caso de la vancomicina, donde se requieren dosis individuales precisas para evitar la toxicidad (ver Cuadro 3).3 Con los betalactámicos o la ciprofloxacina, es más difícil el estudio, porque la PK tiene una variabilidad significativa y resulta necesario explorar otras alternativas.4
La diferencia se logra en los pacientes que tienen un riesgo de dosis baja con dosis estándar, como los enfermos críticos, y también en los pacientes infectados por gram negativos.
La implementación de la dosis individualizada (TDM) depende del acceso a la medición del fármaco. Si esto es posible, lo recomendable es pedir las concentraciones total y libre.
Conclusiones
• Es necesario llenar los vacíos de conocimiento: aún no hay evidencia para la dosis estándar ni para la dosis en relación con la falla renal y el peso del paciente.
• A nivel local y nacional, es necesario el trabajo de equipos multidisciplinarios para lograr la implementación y conocer los efectos en su conjunto.
• Es importante apelar a la colaboración internacional en la búsqueda mancomunada de las dosis estratégicas.
• Las sociedades profesionales pueden tomar la iniciativa y armonizar la dosis, y traducir las guías y los hallazgos, para tener un lenguaje común en todos los niveles de prescriptores, desde los más a los menos expertos.
Referencias
1. Lipman J, et al. A protocol for a phase 3 multicentre randomised controlled trial of continuous versus intermittent β-lactam antibiotic infusion in critically ill patients with sepsis: BLING III. Crit Care Resus. 2019 Mar;21(1):63-68. PMID: 30857514.
2. Tängdén T, et al. The role of infection models and PK/PD modelling for optimising care of critically ill patients with severe infections. Intensive Care Med. 2017 Jul;43(7):1021-1032. doi: 10.1007/s00134-017-4780-6. Epub 2017 Apr 13. PMID: 28409203.
3. Pai MP, et al. Innovative approaches to optimizing the delivery of vancomycin in 3 individual patients. Adv. Drug Deliv. Rev. 2014.http://dx.doi.org/10.1016/j.addr.2014.05.016.
4. Ewoldt TMJ, et al. Model-informed precision dosing of beta-lactam antibiotics and ciprofloxacin in critically ill patients: a multicentre randomised clinical trial. Intensive Care Med. 2022 Dec;48(12):1760-1771. doi: 10.1007/s00134-022-06921-9. Epub 2022 Nov 9. PMID: 36350354; PMCID: PMC9645317.
Tratamientos antimicrobianos cortos para la neutropenia febril
Dra. Carlota Gudiol
Departamento de Enfermedades Infecciosas
Hospital Universitario de Bellvitge
Barcelona, España
El tratamiento de la neutropenia febril con antibioticoterapia empírica puede tener el escenario de una infección documentada clínica o microbiológicamente, o no tener una causa documentada (fiebre de origen desconocido, FOD). En este contexto, la continuación del tratamiento antibiótico empírico inicial por períodos prolongados ofrece varias desventajas: efectos adversos (toxicidad por fármacos, mayor alteración del microbioma que conlleva un aumento del riesgo de enfermedad de injerto contra huésped); superinfecciones (C. difficile, bacterias resistentes, hongos filamentosos); emergencia y diseminación de resistencia a antibióticos; y aumento de costos,1 además de mayores períodos de internación y morbimortalidad. Sin embargo, pese a que sólo el 30% de los pacientes con neutropenia febril tienen una infección documentada, el uso de tratamientos prolongados sigue siendo frecuente.2
Las guías clínicas recomiendan la suspensión de antibióticos en pacientes con fiebre sin causa documentada, estabilidad clínica durante 72-96 horas y apirexia durante 48 horas, independientemente del recuento absoluto de neutrófilos. En los pacientes con infección documentada, se recomienda continuar por un mínimo de 7 días o más, hasta que la infección esté clínicamente resuelta.3 La evidencia actual muestra que no hay aumento de la mortalidad en pacientes con FOD que descontinúan antibióticos, en comparación con quienes continúan bajo tratamiento hasta la resolución de la neutropenia, aunque la certidumbre de este dato es baja (ver Cuadro 4).4

En los pacientes con infección documentada (incluyendo bacteriemia), la evidencia también apoya el uso de cursos cortos de antibióticos,5 pero con monitoreo estrecho del paciente luego de la suspensión, y el reinicio ante cambios clínicos o la reaparición de la fiebre. Es necesario contar con más ensayos clínicos bien diseñados que aporten información con mejor nivel de evidencia para el manejo óptimo de la duración del tratamiento antibiótico en la neutropenia febril.
Conclusiones
• La evidencia existente, aunque aún tiene un nivel de certidumbre bajo, apoya la elección de tratamientos antibióticos cortos en pacientes con fiebre y neutropenia. No resulta necesario esperar a la resolución de la fiebre para suspender antibióticos en pacientes clínicamente estables, tanto en los casos de fiebre sin causa aparente, como en las infecciones documentadas.
Referencias
1. Imlay H, et al. Shorter antibiotic courses in the immunocompromised: the impossible dream? Clin Microbiol Infect. 2023 Feb;29(2):143-149.
2. Punnapuzha S, Edemobi PK, Elmoheen A. Febrile Neutropenia. 2023 Jan 20. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–. PMID: 31082146.
3. Keck JM, et al. Approach to fever in patients with neutropenia: a review of diagnosis and management. Ther Adv Infect Dis. 2022 Nov 26;9:20499361221138346. doi: 10.1177/20499361221138346. PMID: 36451936; PMCID:PMC9703488.
4. Stern A, et al. Early discontinuation of antibiotics for febrile neutropenia versus continuation until neutropenia resolution in people with cancer. Cochrane Database Syst Rev. 2019 Jan 3;1(1):CD012184. doi:10.1002/14651858.CD012184.pub2.
5. Metais A, et al. Efficacy of antibiotic short course for bloodstream infections in acute myeloid leukemia patients with febrile neutropenia: A retrospective comparative study. J Infect. 2022 Jan;84(1):1-7
Implementación de programas ambulatorios en adultos y niños con neutropenia febril
Prof.a Dra. Gabrielle Haeusler
Murdoch’s Children Research Institute
Melbourne, Australia
En el estudio PICNICC, realizado en pacientes pediátricos con neutropenia febril, el 55% de los episodios tuvieron causa no identificada, el 21.6% se produjeron por infección no bacteriémica definida microbiológicamente, el 12.9% presentaron bacteriemia y, el 9.3%, infección definida por criterios clínicos.1 La necesidad de hospitalización afecta negativamente la calidad de vida de los pacientes. Por esta razón, en ellos y su familia, existe una fuerte preferencia por internaciones breves, siempre y cuando esto sea seguro.2
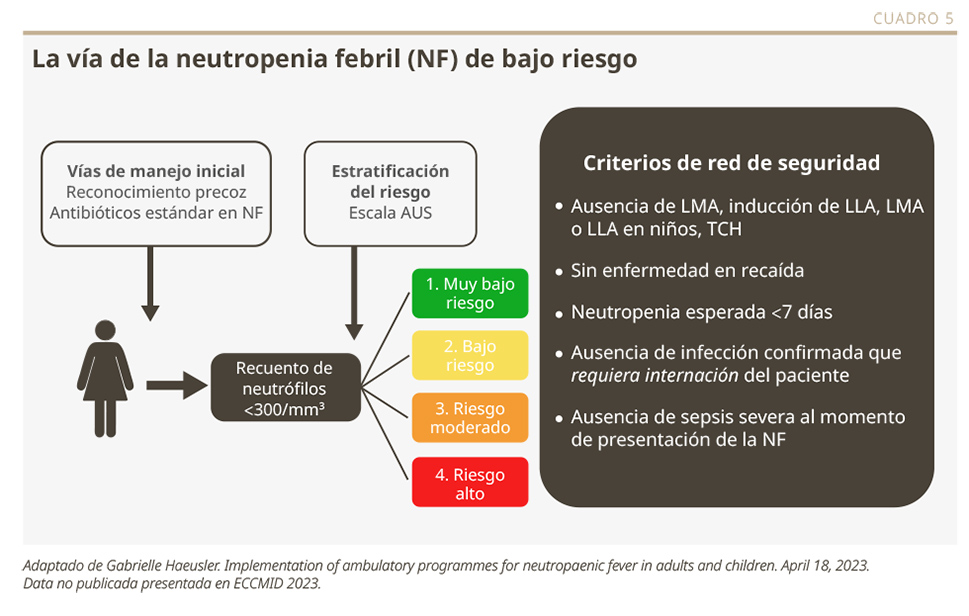
El desarrollo de una herramienta de predicción clínica del riesgo de infección permite estratificar el riesgo de los pacientes y tratarlos en forma ambulatoria de manera segura. La escala AUS consiste en evaluar la presencia (1 punto) o ausencia (0 puntos) de: 1) quimioterapia previa de mayor intensidad a la de mantenimiento por leucemia linfoide aguda (LLA), 2) recuento total de glóbulos blancos <0.3 x 109/L, y 3) recuento de plaquetas <50 x 109/L. Los puntajes finales posibles son 0 (muy bajo riesgo), 1 (bajo riesgo), 2 (riesgo moderado) y 3 (alto riesgo). El uso de esta regla, junto con la exclusión de pacientes por criterios de seguridad adicionales, permite identificar individuos que pueden tratarse de manera ambulatoria entre 4 y 48 horas después del episodio.
Los pacientes clínicamente estables y que cumplen todos los criterios de seguridad pueden ser transferidos a un programa de “neutropenia febril de bajo riesgo” después de un mínimo de 4 horas de observación (puntaje 0, grupo de muy bajo riesgo) o dentro de las 24 horas (puntaje 1, bajo riesgo) (ver Cuadro 5).3 Cuando el puntaje es 2 (riesgo moderado), puede considerarse la transferencia a un programa de “neutropenia febril de bajo riesgo” después de un mínimo de 24 horas de observación. En los pacientes de alto riesgo (puntaje 3), es necesario observar la estabilidad clínica durante un mínimo de 36-48 horas de internación antes de considerar la posibilidad de transferencia. Este protocolo permitió la realización de tratamientos ambulatorios precoces en el 22% de los pacientes. La reducción de la mediana de hospitalización fue de 4.0 a 1.5 días (p=0.05).2 Su utilidad fue revalidada en 13 centros del Reino Unido, donde el 46% de los pacientes fue transferido a su hogar con antibióticos orales dentro de las 24 horas; la tasa de rehospitalización fue del 14%.2
Conclusiones
• Aunque las reglas de predicción de riesgo no deben usarse de manera aislada en la neutropenia febril (esto es, como único criterio para la toma de decisiones), su implementación permite estratificar a los pacientes de modo tal de optimizar la posibilidad de un manejo ambulatorio precoz. Su uso posibilita reducir la duración de las hospitalizaciones, disminuir los costos de salud, y mejorar la calidad de vida de los pacientes y su familia
Referencias
1. Haeusler GM, et al. Risk stratification in children with cancer and febrile neutropenia: A national, prospective, multicentre validation of nine clinical decision rules. EClinicalMedicine. 2020 Jan 7;18:100220.
2. Jackson TJ, et al. Can I go home now? The safety and efficacy of a new UK paediatric febrile neutropenia protocol for risk-stratified early discharge on oral antibiotics. Arch Dis Child. 2023 Mar;108(3):192-197. doi: 10.1136/archdischild-2021-323254. Epub 2022 Dec 12. PMID: 36600323; PMCID: PMC9985710.
3. Gabrielle Haeusler. Implementation of ambulatory programmes for neutropaenic fever in adults and children. April 18, 2023. Data no publicada presentada en ECCMID 2023.